|
 |
 |
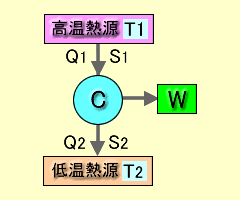
図b20-1カルノー・サイクル概念図 |
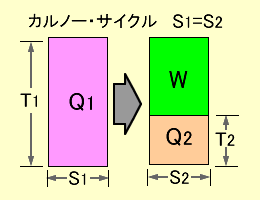
図b20-2 カルノー・サイクルの効率 |
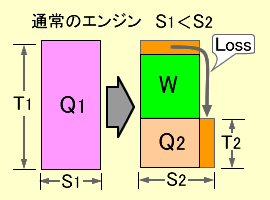
図b20-3 通常の熱機関の効率 |

|
 |
 |
図b20-1カルノー・サイクル概念図 |
図b20-2 カルノー・サイクルの効率 |
図b20-3 通常の熱機関の効率 |
熱力学第2法則は次のようにいくつかの表現方法がありますが、各表現の相互等価性が証明されています。物理学の法則が、このように文章形式で表現されることは例外的といえます。論理的な理解には複数の説明方法が求められ、その結果として「感情的な納得」が得られます。帰宅するには地図やGPSは不要です。
|
(1) クラウジウスによる表現:
(2) トムソンによる表現:
(3) プランクによる表現:
|
これまでの説明がこの熱力学第2法則に集約されると同時にこの熱力学第2法則から驚くほどさまざまな結論を導き出すことが出来ます。しかし、この文章だけから文意を汲み取ることはかなり困難と思われます。そこで僭越ながら熱力学第2法則が告げる要点を整理すると次のようになります。
熱移動の一方性。
熱から仕事への変換を巡る制約性。
不可能性の証明。
この熱力学第2法則はカルノー・サイクルから導かれた結論ですので、図b20-1カルノー・サイクル概念図を用いて説明を加えます。ここでエントロピーを式 (1.8) のように定義します。エントロピーSは、熱量Qを絶対温度Tで割った値に相当します。
S=Q/T …………………………………………………………………………… (1.8)
この関係は図b20-2の左側の図に示す通りです。熱量Qに含まれる無効成分がエントロピーSに相当し、一方の有効成分が絶対温度Tとすれば両者の積が熱量Qとなります。
これらを踏まえて図b20-1カルノー・サイクル概念図に戻ると次のようになります。高温熱源T1からエントロピーS1を含む熱量Q1をカルノー・サイクルCに取り入れます。そのカルノー・サイクルCから仕事Wを取り出して、その残りに相当するエントロピーS2を含む熱量Q2を低温熱源T2に吐き出します。これを式で表わせば次のようになります。
S1=Q1/T1 ……………………………………………………………………… (1.9)
S2=Q2/T2 ……………………………………………………………………… (1.10)
約束によりカルノー・サイクルではエントロピーは発生しませんので図b20-2において次の関係が成り立ちます。
S1=S2 …………………………………………………………………………… (1.11)
式(1.9)と式(1.10)を式(1.11)に代入すると式(1.12)を得ることが出来ます。さらに式(1.12)を変形すれば式(1.13)となります。
Q1/T1=Q2/T2 ………………………………………………………………… (1.12)
Q2/Q1=T2/T1 ………………………………………………………………… (1.13)
一方、効率ηは次の式で与えられれます。
η=W/Q1=(Q1-Q2)/Q1=1-Q2/Q1 ………………………………………… (1.14)
式(1.13)を式(1.14)に代入すれば式(1.15)を得ることが出来ます。
η=1-T2/T1 ………………………………………………………………… (1.15)
図b20-3に示すエントロピーの発生をともなう通常の熱機関の場合は式(1.16)の関係になります。
S1<S2 ……………………………………………………………………… (1.16)
最後にカルノー・サイクルの対極事例として高温熱源T1と低温熱源T2を直接接触させた場合を考えます。
熱力学第1法則により次の関係が成立します。
Q1= Q2 ……………………………………………………………………… (1.17)
式(1.9)および式(1.10)の関係を式(1.17)に代入すれば式(1.18)並びに式(1.19)となります。
T1 S1=T2 S2 ……………………………………………………………… (1.18)
T1/T2=S2/S1 ……………………………………………………………… (1.19)
式(1.19)において T1>T2 ですからS1<S2 となり式(1.16)と同じ結果になります。 エントロピー増大則とはこの関係を指すものです。したがってエントロピーには熱量とともに系に流入する量S1と系の中で発生する量(S2- S1)がありエントロピー増大則とは (S2- S1)>0を告げるものです。